Viruela del mono o mpox: causas, síntomas, diagnóstico y tratamiento
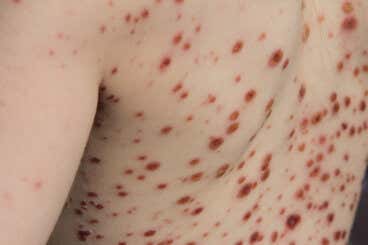
La viruela del mono o mpox es foco de las noticias de salud en todo el mundo. Pero no es una enfermedad nueva. De hecho, desde 1970 se han reportado casos en seres humanos. ¿Por qué pasó de ser una patología endémica del Congo a generar brotes en Europa, América y Australia?
Desde la década de 1980, los casos de viruela del mono se multiplicaron. Con lentitud, pero constantemente. El estudio a nivel científico fue cubriendo algunos vacíos que se tenían sobre el virus causal, pero siguen siendo muchas las dudas.
En este artículo vamos a explicar qué se sabe sobre la enfermedad y cuál es la evidencia actualizada, en el marco de un brote al que la Organización Mundial de la Salud (OMS) presta bastante atención.
¿Qué es la viruela del mono o mpox y cómo se originó?
La viruela del mono en humanos se descubrió por primera vez en el año 1970. El caso cero fue un niño de la República Democrática del Congo que tenía vesículas parecidas a las de la viruela, pero que no cumplía todas las condiciones para ser declarado un caso de aquella enfermedad ya conocida.
Sin embargo, no inició allí la travesía del virus. En realidad, el primer registro científico que existe de este Orthopoxvirus es en primates, a través de un brote en animales de laboratorio, registrado en 1958.
Luego se pudieron aislar anticuerpos contra el agente viral en roedores y en simios de diversas especies con hábitat en África. Aun así, el aislamiento del virus como tal, in vivo, solo se obtuvo 2 veces en la selva africana. Por ello, no sabemos quién es el verdadero reservorio, es decir, dónde encuentra nicho para sobrevivir y luego causar los brotes.
Entonces, es correcto decir que estamos ante una zoonosis. Se trata de aquellas enfermedades que tienen una transmisión habitual entre ciertos animales, pero ocasionalmente se transmiten a humanos y pueden seguir (o no) una vía de contagio interhumana posterior.
Este grupo de los Orthopoxvirus es parte de la familia Poxviridae. Hasta el momento, son 4 las especies de esta categoría que tienen la capacidad de infectar a los humanos:
- Virus de la viruela: es el clásico agente conocido en todo el mundo que tuvo su período de acción intensa y que se erradicó de varios países.
- Virus vaccinia: es el virus que se empleó para la vacuna contra la viruela. Justamente, esta gran campaña de vacunación mundial fue la que llevó a declarar la erradicación en diversas zonas geográficas.
- Virus de la viruela bovina: se transmite desde animales rurales, pero tiene un comportamiento que se asocia a los cautiverios, por lo que también se registraron casos humanos que partieron de zoológicos y circos.
- Virus de la viruela del mono: el que estamos analizando ahora.
La transmisión del virus de la viruela del mono o mpox
La transmisión zoonótica, es decir, desde animales a humanos, es la mejor documentada sobre esta enfermedad. Y los reportes de los que disponemos provienen de África, donde estuvo casi restringido por décadas el agente viral.
Aunque el nombre de viruela del mono o viruela símica haga suponer que los primates no humanos son los principales responsables del paso hacia nuestra especie, lo cierto es que las investigaciones apuntan a los roedores. El consumo de los mismos en las casas rurales, la caza para erradicarlos como plagas y la manipulación de ratas y ardillas parecen ser el primer punto de contacto para la infección.
Así es que en las zonas rurales de África se han podido identificar factores de riesgo que hacen más probable el contagio de animales a humanos. Por ejemplo, el hecho de dormir en el suelo. También si la dieta acostumbra a valerse de animales salvajes (en específico, roedores).
Otros datos han descartado factores que podrían considerarse de riesgo, pero que hasta el momento no lo son, como los siguientes:
- Tener mascotas.
- Entrar en contacto con excremento de animales salvajes.

El contagio interhumano
El brote actual de viruela del mono se debe a la transmisión interhumana, ya que las zonas geográficas lejanas y la simultaneidad de los casos prácticamente descartan que todos sean por el paso zoonótico del agente. Esto no es una novedad, pues desde su descubrimiento hay reportes de contagios interhumanos.
Quizás, lo más llamativo ahora sea la cantidad de pacientes que conforman la cadena de transmisión. Incluso con personas en quienes no se puede definir la cadena en sí; no sabemos cómo se pudieron contagiar y todos sus contactos estrechos no tienen síntomas.
En los reportes anteriores de brotes de las décadas de 1980 y de 1990, la cadena de transmisión llegó, como máximo, a 8 personas. Esto significa que no más de esa cantidad de contactos estrechos desde el caso cero pudieron ser confirmados con el diagnóstico.
Esto representa una tasa de ataque muy baja si se la compara con otras patologías similares. La tasa de ataque es una medida de la epidemiología para determinar qué porcentaje de las personas más cercanas a un paciente se contagian al convivir o al pasar tiempo juntos.
La viruela símica tuvo tasas de ataque de un máximo de 11 %. Si comparamos con la viruela clásica, el dato es insignificante, pues esta tiene una tasa de ataque de 80 %.
Aunque se asume que el contacto estrecho es la vía de transmisión, lo más específico que se conoce es que el contagio interhumano provendría de la vía aérea y la cutánea, a través de las gotitas que salen con la respiración y de la piel-a-piel.
Al igual que sucede con la viruela común, las lesiones en la piel y los líquidos que se desprenden de ellas son contagiosos. El virus puede viajar a través de las secreciones para alcanzar otros objetos y otros humanos.
La tasa de ataque baja y la falta de información en la cadena de transmisión del brote actual no permiten definir con mayor claridad las circunstancias que hacen efectivo el contagio. Si es una vía aérea común (como la de la gripe), ¿por qué no se contagian más contactos estrechos de los pacientes ya confirmados?
Un dato particular que se analiza en el brote actual es la transmisión sexual. Pareciese que es un factor común entre los pacientes en los que se logra establecer la cadena de contagios. Pero no hay confirmación y algunos especialistas ni siquiera la consideran una vía posible.
De todas maneras, Reino Unido ha recomendado a los pacientes que utilicen preservativos para sus relaciones, como medida de precaución, hasta 8 semanas luego del diagnóstico. Esto se refuerza con los últimos hallazgos del equipo científico del Instituto Spallanzani de Italia, que reconocieron partes del agente viral en muestras de semen de algunos pacientes.
En general, todavía no se sabe con seguridad si la viruela del mono es infecciosa a través del semen. Se sospecha y es muy probable que lo sea. Pero faltan pruebas formales que estarán disponibles con más experimentos en el laboratorio.
¿Cuáles son los síntomas de la enfermedad?
El período de incubación de la viruela del mono, o sea, el tiempo que pasa desde el contacto con el virus hasta la aparición de los primeros síntomas, oscila entre 6 y 16 días. No hay claridad al respecto, pero 2 semanas parece ser el promedio.
El cuadro clásico inicia con fiebre que puede durar entre 1 a 4 días. La misma se acompaña de la sintomatología clásica de los cuadros febriles, con dolor de cabeza, fatiga, mialgias y somnolencia.
Luego inicia el brote dérmico característico. Lo que se ha descrito hasta ahora es una presentación centrífuga (comienza en el tronco del cuerpo y sigue hacia las extremidades) de máculas (manchas) y pápulas (sobreelevaciones de la piel), junto a vesículas (con contenido líquido) y pústulas (con contenido de pus) que evolucionan a costras.
La inflamación de los ganglios linfáticos es notoria en la viruela del mono. Esto la distingue de la viruela clásica que casi no presenta linfadenopatías.
La gravedad del cuadro clínico puede ser leve (la mayoría de las veces) o fatal (solo 1 % es la tasa de mortalidad en África). Los casos graves suelen complicarse con vómitos y diarrea, encefalitis y neumonía. Algunos de ellos llegan a la sepsis y fallecen por una falla multiorgánica.
Hay una reducción de la respuesta inmune en los pacientes, lo que puede favorecer la sobreinfección con bacterias. Esta es una de las explicaciones de los casos fatales que llegan a la sepsis.
En las embarazadas hay una situación particular, porque presentan una mayor tasa de mortalidad y de complicaciones cuando se infectan con la viruela del mono. Del mismo modo, algunos reportes han confirmado que hay transmisión vertical, es decir, desde la madre al feto.
El caso sospechoso
A lo largo de la historia, desde 1970 hasta ahora, se han dado diferentes definiciones de un caso sospechoso de viruela del mono. Esto se hace para identificar a los pacientes y aislarlos.
Cada país establece cuáles son los signos de alarma para consultar y ante qué características deberían responder los sistemas de salud. Pero en líneas generales, se coincide en que una persona es sospechosa de padecer la enfermedad cuando tiene fiebre y una erupción cutánea de vesículas, junto con al menos 1 de los siguientes 3 síntomas:
- Rash en las palmas de las manos o en las plantas de los pies.
- Inflamación de los ganglios linfáticos.
- Episodios de elevación de la temperatura corporal antes de que aparezca el rash.
Por supuesto, a esto se añade la investigación sobre quiénes estuvieron con el paciente sospechoso. Si la persona con estos signos ha estado en contacto estrecho con alguien que ya tiene el diagnóstico confirmado, entonces la posibilidad de ser positivo aumenta.
¿Cómo se confirma el diagnóstico?
El primer paso en el camino del diagnóstico de la viruela del mono inicia con la sospecha. Estos serían aquellos casos sospechosos según la definición que dimos antes.
Habría que aislar a esos pacientes y comenzar las pruebas para determinar si se puede confirmar o no la patología. Esto no es algo rápido, puesto que no se trata todavía de un agente viral del que se tenga amplia disponibilidad en todo el mundo para el testeo.
En varios lugares se ha optado por solicitar pruebas de inmunoglobulinas IgG e IgM contra Orthopoxvirus. No es algo específico, pero si el resultado es positivo permite avanzar en la confirmación, mientras se esperan resultados más concretos que podrían demorar.
Estas pruebas más concretas son 3 y dependen de la disponibilidad que haya en cada centro de salud:
- Reacción en cadena de la polimerasa (PCR).
- Inmunohistoquímica.
- Microscopía electrónica.
Es habitual que estos métodos solo estén disponibles en algunos centros que reciben muestras de otras zonas geográficas. Por lo tanto, la demora es casi ineludible y se debe aplicar el aislamiento de los sospechosos, mientras se espera.
Las inmunglobulinas, la PCR y la inmunohistoquímica requieren una muestra de sangre del paciente. La microscopía electrónica se emplea para hacer un análisis visual de las secreciones si se recolectan las mismas para enviar al laboratorio.
¿Cuál es el tratamiento de la viruela del mono o mpox?
La viruela símica no tiene un tratamiento concreto y específico. Como muchas patologías virales, no hay un fármaco en particular que sea capaz de bloquear o anular la replicación del agente patógeno.
Por lo tanto, lo que se propugna es un aislamiento con medidas de sostén. Hay pacientes con cuadros leves que no requieren ningún abordaje farmacológico. Otros presentan una severidad que amerita la prueba con antivirales.
No existe evidencia suficiente sobre la efectividad de los antivirales para reducir las complicaciones. Se reservan como uso a criterio del equipo tratante en aquellas personas que empeoran o que tienen riesgo de muerte, o sea, en el 1 % de los diagnosticados.
Brincidofovir y tecovirimat son los nombres de dos drogas que se han estudiado para el tratamiento de los Orthopoxvirus. Se tiene más experiencia con ellos en el campo de la viruela clásica, por lo que hoy representan la opción al alcance para el brote.
Por otro lado, las complicaciones ameritan su propio esquema terapéutico. Las sobreinfecciones bacterianas, que son comunes en los casos graves, se abordan con antibióticos específicos para el microorganismo que se haya identificado.
En las neumonías o en las encefalitis que aparecen como complicación durante una internación, es posible que el equipo médico decida brindar soporte vital. Esto se logra con respiración asistida, si los parámetros clínicos lo ameritan. No difiere mucho de lo que se hace con cuadros similares causados por otras etiologías.
El alta médica
Todavía existe discusión sobre cuándo dar el alta a los pacientes. La mayoría se recupera satisfactoriamente y no tiene secuelas. Pero la cuestión del contagio interhumano es lo que determina la duda sobre el momento para permitir que se acabe el aislamiento.
En los brotes anteriores, tanto en África como en algunos registrados en Estados Unidos y el Reino Unido, se propuso el alta al desaparecer las costras de los pacientes. Se asume que en ese momento ya no hay contagio. Al igual que sucede con la viruela clásica.
La recomendación europea especifica que los sospechosos y los confirmados deben guardar aislamiento hasta tanto no tener más costras.
Sin embargo, en algunos pacientes se han encontrado resultados de PCR positivos en las vías respiratorias, hasta 3 semanas luego de la desaparición de las costras. No está confirmado si eso significa capacidad de contagio.
También por reportes anteriores sabemos que hay pacientes que vuelven a tener linfadenopatías y rash cutáneos tras tener relaciones sexuales luego del alta. Esto hace sospechar de un afincamiento del virus en la zona genital, lo que podría prolongar la transmisión por esa vía mucho tiempo después.
¿Existe una vacuna?
La Administración de Alimentos y Medicamentos de Estados Unidos (FDA) aprobó una vacuna llamada JYNNEOS ® en el año 2019. Esta inmunización sería efectiva contra la viruela común y la viruela símica.
No se ha determinado que la misma esté disponible para su comercialización masiva, pero Estados Unidos iniciará una campaña masiva para profilaxis de sus ciudadanos. En otro plan, Europa se focaliza en personas que están en riesgo y en contactos estrechos de casos confirmados.
La OMS sugiere 2 grupos prioritarios para vacunar:
- Los contactos estrechos de casos confirmados deben recibir la vacuna con celeridad, dentro de los 4 días de la posible exposición al agente viral.
- Los trabajadores de la salud en zonas geográficas con casos confirmados deberían recibir dosis antes de saber si estuvieron expuestos, a manera de profilaxis.
El plan de vacunación con este vial es de 2 dosis que deben tener 1 mes de distancia entre sí. Los países de la Unión Europea están trabajando en las cuestiones legales para adquirir dosis y colocarlas a los contactos estrechos con celeridad.
Sí se sabe que aquellos vacunados con la vacuna clásica contra la viruela tienen ventaja. Se calcula que la protección brindada por esa inmunización frente a la viruela del mono es de un 85 %, lo que se considera más que aceptable.
Reino Unido y otros países vacunaron con la inmunización clásica al personal de salud.
En efecto, parte de la singularidad de este brote actual se artibuye a que hay menos personas vacunadas con la viruela común debido a las zonas geográficas que se declararon erradicadas. Esto habría aumentado la sensibilidad de las poblaciones a virus de la misma familia.
El brote actual: lo que sabemos
El brote actual de viruela del mono se considera iniciado el día 7 de mayo de 2022, cuando el Reino Unido reportó un caso fuera de África. A pesar de ello, algunos epidemiólogos proponen que se extienda el período desde el año 2021, cuando Estados Unidos registró una serie pequeña de casos en su territorio.
Desde inicios de mayo hasta el momento, hay más de 30 países involucrados. Por otro lado, sin consideramos la región africana, los casos sospechosos incluyen allí a 8 países distintos.
Es una situación inédita. La Organización Mundial de la Salud ha declarado el brote, pero especifica que hay posibilidad de controlarlo. Además de que el riesgo para la población general es bajo.
Australia registró el primer caso en Melbourne por una persona que volvía del Reino Unido. Argentina y México tuvieron el inicio de los contagios en América Latina. Luego los siguieron Venezuela y Brasil. Hoy, Brasil es el país con más transmisión en América.
¿Qué podemos hacer?
Las medidas de prevención para no contraer viruela del mono tienen que ver con algunas pautas generales y con restricciones que se tienen que aplicar ante circunstancias puntuales. Entre las primeras podemos mencionar las siguientes:
- Lavado de manos con frecuencia.
- Manipular alimentos de origen animal con máximas medidas de salubridad.
- Solo adquirir productos alimenticios de origen animal en lugares y establecimientos habilitados.
- Al viajar, alojarse en sitios que estén certificados por las autoridades sanitarias y donde estén expuestos los controles de plagas realizados en las habitaciones.
- Si se visitan reservas naturales, como parques temáticos o zoológicos, no entrar en contacto con los animales y mantener una distancia prudencial con ellos.
Respecto a las restricciones particulares, hay que hacer hincapié en que un contacto en los últimos 14-21 días con personas enfermas o el hecho de haber viajado a una zona geográfica con brote, implican consultar con las autoridades sanitarias. Se debe proceder al aislamiento y al rastreo con los métodos complementarios.
El autoaislamiento hasta consultar debería ser una norma para las personas que reúnen estas características. Del mismo modo, los familiares y convivientes deberían seguir el mismo procedimiento hasta que haya confirmación positiva o negativa.
Es importante no entrar en pánico. Como bien lo aclaró la OMS, no estamos ante una situación de pandemia todavía ni hay un riesgo incrementado para la población general, por lo que basta con medidas generales de higiene, identificar los síntomas de manera temprana y consultar ante la duda.
Todas las fuentes citadas fueron revisadas a profundidad por nuestro equipo, para asegurar su calidad, confiabilidad, vigencia y validez. La bibliografía de este artículo fue considerada confiable y de precisión académica o científica.
- Marennikova SS, Seluhina EM, Malceva NM, Ladnyj ID. Poxviruses isolated from clinically ill and asymptomalically infected monkeys and a chimpanzee. Bulletin of the World Health Organization. 1972;46(5):613–20. pmid:4340220.
- Doty JB, Malekani JM, Kalemba LN, Stanley WT, Monroe BP, Nakazawa YU, et al. Assessing Monkeypox Virus Prevalence in Small Mammals at the Human-Animal Interface in the Democratic Republic of the Congo. Viruses. 2017;9(10):03. pmid:28972544.
- Ogoina D, Iroezindu M, James HI, Oladokun R, Yinka-Ogunleye A, Wakama P, Otike-Odibi B, Usman LM, Obazee E, Aruna O, Ihekweazu C. Clinical course and outcome of human monkeypox in Nigeria. Clinical Infectious Diseases. 2020 Oct 15;71(8):e210-4.
- Coto, C. E. (2009). Virus sin fronteras: el caso del virus cow pox, agente de la viruela bovina. Química Viva, 8(2), 57-63.
- Reynolds MG, Carroll DS, Olson VA, Hughes C, Galley J, Likos A, et al. A silent enzootic of an orthopoxvirus in Ghana, West Africa: Evidence for multi-species involvement in the absence of widespread human disease. American Journal of Tropical Medicine and Hygiene. 2010;82(4):746–54. pmid:20348530
- Mbala PK, Huggins JW, Riu-Rovira T, Ahuka SM, Mulembakani P, Rimoin AW, et al. Maternal and Fetal Outcomes among Pregnant Women with Human Monkeypox Infection in the Democratic Republic of Congo. Journal of Infectious Diseases. 2017;216(7):824–8. pmid:29029147.
- Jezek Z, Grab B, Szczeniowski M, Paluku KM, Mutombo M. Clinico-epidemiological features of monkeypox patients with an animal or human source of infection. Bulletin of the World Health Organization. 1988;66(4):459–64. pmid:2844428
- Nolen LD, Osadebe L, Katomba J, Likofata J, Mukadi D, Monroe B, Doty J, Hughes CM, Kabamba J, Malekani J, Bomponda PL, Lokota JI, Balilo MP, Likafi T, Lushima RS, Ilunga BK, Nkawa F, Pukuta E, Karhemere S, Tamfum JJ, Nguete B, Wemakoy EO, McCollum AM, Reynolds MG. Extended Human-to-Human Transmission during a Monkeypox Outbreak in the Democratic Republic of the Congo. Emerg Infect Dis. 2016 Jun;22(6):1014-21. doi: 10.3201/eid2206.150579. Erratum in: Emerg Infect Dis. 2016 Oct;22(10 ): PMID: 27191380; PMCID: PMC4880088.
- Reynolds, M. G., Yorita, K. L., Kuehnert, M. J., Davidson, W. B., Huhn, G. D., Holman, R. C., & Damon, I. K. (2006). Clinical manifestations of human monkeypox influenced by route of infection. The Journal of infectious diseases, 194(6), 773-780.
- Mwanbal, P. T., Tshioko, K. F., Moudi, A., Mukinda, V., Mwema, G. N., Messinger, D., ... & Esposito, J. J. (1997). Casos humanos de viruela de los monos en Kasai Oriental, Zaire (1996-1997). Eurosurveillance, 2(5), 33-35.
- Chittick G, Morrison M, Brundage T, Nichols WG. Short-term clinical safety profile of brincidofovir: A favorable benefit–risk proposition in the treatment of smallpox. Antiviral research. 2017 Jul 1;143:269-77.
- Grosenbach DW, Honeychurch K, Rose EA, Chinsangaram J, Frimm A, Maiti B, Lovejoy C, Meara I, Long P, Hruby DE. Oral tecovirimat for the treatment of smallpox. New England Journal of Medicine. 2018 Jul 5;379(1):44-53.
- Reynolds MG, Davidson WB, Curns AT, Conover CS, Huhn G, Davis JP, et al. Spectrum of infection and risk factors for human monkeypox, United States, 2003. Emerging Infectious Diseases. 2007;13(9):1332–9. pmid:18252104.
- Panning M, Asper M, Kramme S, Schmitz H, Drosten C. Rapid detection and differentiation of human pathogenic orthopox viruses by a fluorescence resonance energy transfer real-time PCR assay. Clinical Chemistry. 2004;50(4):702–8. pmid:14962998.
